Ենթահարց 1` Ո՞րն է համարվում մաքուր խմելու ջուրՏարբերում են աղտոտման հետևյալ ձևերը՝քիմիական աղտոտում՝ պեստիցիդների, հանքային պարարտանյութերի, թունավոր գազերի, ծանր մետաղների (սնդիկ, կապար, կադմիում և այլն), ճառագայթաակտիվ իզոտոպների, ֆտորի միացությունների, սինթետիկ լվացամիջոցների ներգործության հետևանք է,Օդի և ջրի նման՝ հողը ևս ենթակա է աղտոտման։ Դրա աղտոտման աղբյուրներից մեկը մթնոլորտն է։ Մթնոլորտի աղտոտիչները նստում են հողի մակերևույթին։ Հողի աղտոտման աղբյուրներ են նաև մետաձուլական գործարանների, նավթաարդյունաբերական և արդյունաբերական այլ ձեռնարկությունների թափոնները։ Հողի աղտոտման մեկ այլ աղբյուր է ժամանակակից գյուղատնտեսությունը, որը չի կարող չկիրառել թունաքիմիկատներ և պարարտանյութեր, քանի որ դրանց բացակայության դեպքում բերքի մեծ կորուստներ ունենալու վտանգ է սպառնում։ Վտանգը մեղմացնելու նպատակով շատ տնտեսություններում կիրառվում են վնասատուների դեմ պայքարի կենսաբանական եղանակներ և օրգանական, անվտանգ պարարտանյութեր։
- Մարդկությանը հուզող ինչպիսի՞ էկոլոգիական հիմնախնդիրներ գիտեք
1. Երկրագնդի անտառազրկումը4. Քաղցրահամ ջրերի որակի վատացումը
- Ո՞րն է էկոլոգիապես մաքուր սնունդը
էկոլոգիապես մաքուր սնունդը մարդու նորմալ կենսագործունեության հիմքն է:
- Ի՞նչ կարծիք ունեք կենսական միջավայրի մասին
Շատ լավ կարծիք ունեմ կենսական միջավայրի մասին, որովհետև օրեցօր ծաղկում է:
- Որո՞նք են առողջ ապրելակերպի սկզբունքները
- Էկոլոգիապես մաքուր սնունդ, մաքուր օդ, մաքուր ջուր
- Առողջ քուն
- Հիգիենա, սպորտ, մարմնամարզություն
- Վատ սովորությունների ձերբազատում
- սթրեսային իրավիճակներից պետք է դուրս գալ հումորով և կատակով:
- Ո՞րն է համարվում մաքուր խմելու ջուր
Մաքուր խմելու ջուրը պիտի պարունակի հանքային աղեր՝ դառը անհամ ջուրը: Եթե ջուրը բաղկացած է 100 մանրէյից, կամ հենց 100 մանրէ պետք չի խմել: Ջրից, եթե քլորի հոտ է գալիս չի կարելի խմել:
- Ջրի շրջապտույտը բնության մեջ
Ջրի շրջապտույտը բնության մեջ: Ջրի ծավալր Երկրի վրա միշտ հաստատուն է և չի փոխվում: Սակայն այդ ջուրը գտնվում է անընդհատ շարժման մեջ՝ անցնելով ջրոլորտի մի բաղադրիչից մյուսին, ինչպես նաև’ մի վիճակից մյուսին: Այսինքն՝ տեղի է ունենում ջրի շրջապտույտ:Տեղական կամ փոքր շրջապտույտ: Երկրի մակերևույթից Արեգակի ճառագայթների ազդեցության տակ ջուրն արագ գոլորշանում է, և գոլորշիները բարձրանում են վեր: Որոշ բարձրության վրա դրանք, սառելով ու խտանալով, տեղումների ձևով թափվում են Երկրի մակերևույթին: Եթե այս գործրնթացր տեղի է ունենում սահմանափակ տարածքի վրա, ապա կոչվում է տեղական կամ փոքր շրջապտույտ:Ջրի շրջապտույտի նշանակությունը: Ջրի շրջապտույտր չափազանց կարևոր նշանակություն ունի Երկիր մոլորակի համար:Միլիոնավոր տարիների րնթացքում ջրի շրջապտույտի միջոցով ցամաքից օվկիանոս են տեղափոխվում հսկայական քանակությամբ տիղմ, ավազ և լուծված նյութեր: Օվկիանոսները հարստանում են ոչ միայն գետերի բերած աղերով, այլև’ տեղում գոլորշացման հետևանքով անջատված աղերով: Դա՝ է պատճառը, որ օվկիանոսի ջուրն աղի է և աստիճանաբար ավելի է աղիանալու:
- Ջրի աղտոտման տեսակները որո՞նք են
Տարբերում են աղտոտման հետևյալ ձևերը՝քիմիական աղտոտում՝ պեստիցիդների, հանքային պարարտանյութերի, թունավոր գազերի, ծանր մետաղների (սնդիկ, կապար, կադմիում և այլն), ճառագայթաակտիվ իզոտոպների, ֆտորի միացությունների, սինթետիկ լվացամիջոցների ներգործության հետևանք է,
- Ի՞նչ է կոշտ ջուրը և ինչպե՞ս են այն վերացնում
Ջրի կոշտությունը պայմանավորված է ջրում պարունակվող կալցիումի, մագնեզիումի, երկաթի, ածխաթթվական և ծծմբաթթվական աղերով: Փափուկ է համարվում այն ջուրը, որի 1 լ-ը պարունակում է մինչև 3 մգ աղեր, կոշտ ջուրը՝ 6-9 մգ։ Մեծ քանակությամբ երկաթի պարունակության դեպքում փոխվում է ջրի գույնը (դառնում է ժանգագույն), զգացվում է մետաղի համը, եռացնելիս կաթսայում գոյանում է գորշ կարմրավուն նստվածք: Կոշտ ջրով սպիտակեղենը լվանալիս մեծանում է օճառի ծախսը և առաջանում է նստվածք, ինչը բացասաբար է անդրադառնում թե՛ կտորի որակի և թե՛ մաշկի առողջական վիճակի վրա։ Կոշտ ջրով լողանալու դեպքում փակվում են մաշկի ծակոտիները, առաջանում է թեփոտում, կորյակներ, ալերգիկ ցան։ Կոշտ ջուր խմելիս օրգանիզմում առաջանում է չլուծվող կալցիումի և մագնեզիումի նստվածք, որը դառնում է միզաքարային հիվանդության պատճառ։ Կոշտ ջրում վատ են եփվում բանջարեղենն ու միսը, իսկ թեյը վատ է թրմվում ևվատանում է համային հատկությունները:
Միացման ռեակցիայի ելանյութերը կարող են լինել ինչպես պարզ, այնպես ել բարդ նյութեր:





2Al+3J2=2AlJ3


Cu(OH)2=CuO+H2O

2H2O=2H2+O2

Zn+2HCl=H2↑+ZnCl2
Քիմիական կապը, որն առաջանում է երկու ատոմի միջև ընդհանրացված էլեկտրոնային զույգի միջոցով կոչվում է կովալենտային:
H⋅+⋅H→H:H
8 էլեկտրոն պարունակող արտաքին էներգիական մակարդակ ունենալու ձգտումն է:
Նատրիումի ատոմն իր արտաքին շերտի մեկ էլեկտրոնը տրամադրում է ֆտորի ատոմին և փոխարկվում է ութ էլեկտրոն պարունակող, կայուն, դրական լիցքավորված մասնիկի, այսինքն` ստացվում է նեոն(Ne) իներտ գազի էլեկտրոնային կառուցվածք.
Na0−e−→Na+
F0+e−→F−












Քիմիական ռեակցիաները բազմաթիվ են ու բազմաբնույթ: Մի շարք ընդհանուր հատկությունների համաձայն, քիմիական ռեակցիաները հնարավոր է դասակարգել, որը բավական դյուրացնում է նրանց ուսումնասիրությունը:
Ըստ սկզբնանյութերի և վերջանյութերի թվի ու բաղադրության՝ ռեակցիաները լինում են.
- միացման
- քայքայման
- տեղակալման
- փոխանակման
Միացման քիմիական ռեակցիայի ժամանակ երկու կամ ավելի նյութերից ստացվում է մեկ բարդ նյութ:
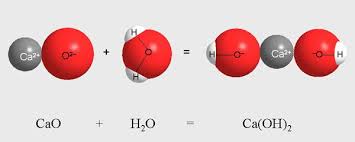
Օրինակ, երկու բարդ նյութերի՝ կալցիումի օքսիդի և ջրի փոխազդեցությունից ստացվում է մեկ ավելի բարդ նյութ՝ կալցիումի հիդրօքսիդ:


Կալցիումի օքսիդի և ջրի միացման ռեակցիան
Երկու պարզ նյութերի՝ ալյումինի և յոդի փոխազդեցությունից առաջանում է մեկ բարդ նյութ՝ ալյումինի յոդիդ:




Ալյումինի և յոդի միացման ռեակցիան
Քայքայման ռեակցիայի ժամանակ մեկ բարդ նյութի քայքայումից ստացվում են երկու կամ ավելի նյութեր:
Ստացվող նյութերը կարող են լինել և՛բարդ, և՛ պարզ:
Օրինակ, մեկ բարդ նյութից՝ պղնձի (II) հիդրոքսիդի քայքայումից առաջանում են երկու բարդ նյութ՝ պղնձի (II) օքսիդ և ջուր:


Պղնձի (II) հիդրոքսիդի քայքայումը
Մեկ բարդ նյութի՝ ջրի քայքայումից առաջանում են երկու պարզ նյութ՝ջրածին և թթվածին:

Ջրի քայքայումը
Տեղակալման է պարզ և բարդ նյութերի միջև ընթացող այն քիմիական ռեակցիան, որի ժամանակ պարզ նյութը կազմող ատոմները տեղակալում են բարդ նյութի բաղադրությունում առկա տարրերից որևէ մեկի ատոմները:
Օրինակ, պարզ նյութ՝ ցինկի և բարդ նյութ աղաթթվի փոխազդեցությունից առաջանում են նոր պարզ նյութ՝ ջրածին և բարդ նյութ՝ ցինկի քլորիդ:

Ցինկի և աղաթթվի փոխազդեցությունը.
Քիմիական կապը, որն առաջանում է երկու ատոմի միջև ընդհանրացված էլեկտրոնային զույգի միջոցով կոչվում է կովալենտային:
Օրինակ
Ջրածնի ատոմները միանում են մեկ ընդհանուր էլեկտրոնային զույգով՝ ըստ հետևյալ ուրվագրի՝
Նոր առաջացած էլեկտրոնային զույգը, որն անվանվում է նաև ընդհանրացված, միաժամանակ և հավասարաչափ պատկանում է ջրածնի երկու ատոմին: Ընդհանուր էլեկտրոնային զույգը ձգվում է ջրածնի երկու ատոմների դրական լիցքավորված միջուկների կողմից, «ցեմենտում» դրանք՝ ապահովելով մոլեկուլի կայունությունը:
Իոնային կապ
Քիմիական կապի առաջացման հիմնական շարժիչ ուժն ատոմի՝
Քննարկենք, թե ինչպես կարող է քիմիական կապ առաջանալ էլեկտրաբացասականությամբ միմյանցից կտրուկ տարբերվող ատոմների միջև, օրինակ` նատրիումի (Na) և ֆտորի(F):
Նատրիումի ատոմն իր արտաքին շերտի մեկ էլեկտրոնը տրամադրում է ֆտորի ատոմին և փոխարկվում է ութ էլեկտրոն պարունակող, կայուն, դրական լիցքավորված մասնիկի, այսինքն` ստացվում է նեոն
Ֆտորի ատոմն արտաքին էլեկտրոնային շերտում յոթ էլեկտրոն ունի, և կայուն վիճակի համար ֆտորի ատոմին ընդամենը մեկ էլեկտրոն է պակասում, ուստիև ավարտուն արտաքին էներգիական մակարդակ ստանալու համար շատ ավելի հեշտ է այդ ատոմին մեկ էլեկտրոն միացնել: Այդ մեկ էլեկտրոնը նատրիումի ատոմից վերցնելիս ֆտորի ատոմը փոխարկվում է 8 էլեկտրոն պարունակող, կայուն արտաքին շերտով, բացասական լիցքավորված մասնիկի այսինքն, ստացվում է նեոն (Ne) իներտ գազի էլեկտրոնային կառուցվածք.
Դրական (Na+) և բացասական F− մասնիկների միջև էլեկտրաստատիկական ձգողության ուժեր են ծագում, և որպես արդյունք՝ առաջանում է նատրիումի ֆտորիդ նյութը:
https://www.slideshare.net/mkrtchyanmilushik/ss-82497254


Օքսիդները բավականին տարածված են երկրի ընդերքում և առհասարակ տիեզերքում։ Օրինակ այդպիսի միացություններից է ժանգը, ջուրը, շաքարավազը, ածխաթթու գազը։
ՍԱՀՄԱՆՈՒՄԸ `
Մոլեկուլում -2 օքսիդացման աստիճանով թթվածնի ատոմ պարունակող երկտարր այն միացությունները, որոնցում թթվածնի ատոմներն անմիջականորեն միացած են մեկ այլ տարրի ատոմների հետ, իսկ միմյանց հետ միացած չեն, անվանվում են օքսիդներ:
ԴԱՍԱԿԱՐԳՈՒՄԸ `
Օքսիդնեռրը դասակարգվում են ըստ տարբեր հատկանիշների։Ըստ բաղադրության`
- Մետաղների օքսիդներ
- Ոչ մետաղների օքսիդներ
Ըստ քիմիական հատկությունների օքսիդները բաժանվում են 4 հիմնական դասերի՝ հիմնային, թթվային, երկդիմի և աղ չառաջացնող։
- Հիմնային օքսիդներ
Հիմնային են կոչվում այն օքսիդները, որոնց համապատասխանող հիդրատները հիմքեր են:Հիմնային օքսիդների օրինակներ են ` Na2O,CaO,CuO,FeO,MnO,Cu2O և այլն։Եթե օքսիդ առաջացնող տարրը ալկալիական կամ հողալկալիական մետաղ է կամ այլ մետաղ է, որը ցուցաբերում է այդ օքսիդում նվազագույն վալենտականություն (I,II),ապա օքսիդը որպես կանոն հիմնային է:



նատրիումի օքսիդ՝ Na2O կալցիումի օքսիդ՝ CaO պղնձի (II) օքսիդ՝ CuO
- Թթվային օքսիդներ
Եթե օքսիդ առաջացնող տարրը ոչ մետաղ է, ապա այդ օքսիդը հիմնականում՝ թթվային է:Կամ ` թթվային են կոչվում այն օքսիդները, որոնց համապատասխանող հիդրատները թթուներ են։Եթե օքսիդ առաջացնող տարրի ատոմը ցուցաբերում է մետաղական հատկություն և առավելագույն վալենտականություն (V-VIII), ապա oքսիդը թթվային է:


ֆոսֆորի (V) օքսիդ՝ P2O5 քրոմի (VI) օքսիդ՝ CrO3
- Ամֆոտեր կամ երկդիմի օքսիդներ
Նյութերը, որոնք ցուցաբերում են և թթվային, և հիմնային հատկություններ,անվանվում են երկդիմի(ամֆոտեր):Եթե օքսիդ առաջացնող տարրը ցուցաբերում է մետաղական հատկություններ և բարձր վալենտականություն (III, IV), ապա օքսիդըերկդիմի է: .Երկդիմի (ամֆոտեր) օքսիդներ՝ են BeO,ZnO,Al2O3,Cr2O3 և այլն:


ալյումինի օքսիդ՝ Al2O3 ցինկի օքսիդ՝ ZnO


քրոմի (III) օքսիդ՝ Cr2O3 բերիլիումի օքսիդ՝ BeO
- Անտարբեր (աղ չառաջացնող) օքսիդներ
Ոչ մետաղների օքսիդները, որոնք թթուների ու հիմքերի հետ սովորական պայմաններում չեն փոխազդում, կոչվում են անտարբեր օքսիդներ:Անտարբեր (աղ չառաջացնող) օքսիդների օրինակներ են` N2O,NO,CO,SiO և այլն։

սիլիցիումի (II) օքսիդ՝ SiO ածխածնի (II) օքսիդ՝ CO

Օքսիդների ստացման եղանակները
- թթվածնի հետ պարզ և բարդ նյութերը փոխազդելիս
C+Օ
4Al+3O2=2Al2O3
2ZnS+3O2=2ZnO+2SO2
- թթվածին պարունակող բարդ նյութերի ` տաքացման պայմաններում քայքայվելիս
Mg(OH)2=MgO+H2O
CaCO3=CaO+CO2
H2SiO3=SiO2+H2O
- աղի ու թթվի փոխազդեցությունից.
Na2CO3 + H2SO4 = Na2SO4+ CO2↑ + H2O
K
- Մետաղի ու օքսիդի փոխազդեցությունից
2 Al + Fe2O3 = Al2O3 + 2 Fe
Կիրառությունը`
Օքսիդների կազմի մեջ են մտնում այնպիսի միացություններ, որոնք լայնորեն տարածված են երկրագնդում օրինակ ավազը, ջուրը։ Ավազը օգտագործվում է շինարարության մեջ, ինչպես նաև ապակու , խեցու և մի շարք այլ արտադրություններում։Մեծ կիրառությու ունի չհանգած կիրը (կալցիումի օքսիդը)։ Այն օգտագործվում է գյուղատնտեսությն և շինարարության մեջ։ Ֆոսֆորի հնգավալենտ օքսիդը , ջրազրկող նյութ է. այն կլանում է ջուրը։Ածխածինի քառավալենտ օքսիդը կրառվում է ոգելից (շամպայնը) և ոչ ոգելից (լիմոնադ, հանքային ջրեր) խմիչքներ գազավորելիս, իսկ պինդ օքսիդը կամ ինչպես ասում են չոր սառույցը` սննդի արդյունաբերությունում,բժշկության մեջ և այլն։ Որոշ օքսիդներ հանդիսանում են թանկարժեք քարերի հումք։
Օքսիդների քիմիական հատկություններ
Հիմնային օքսիդներին բնորոշ է թթուների, թթվային օքսիդներին ` ալկալիների, իսկ երկդիմի օքսիդներին ` և՛ ալակալիների, և՛ թթուների հետ փոխազդեցությունը` բոլոր դեպքերում աղ և ջուր առաջացնելով։
Հիդրատացման ռեակցիա է անվանվում այնպիսի միացման ռեակցիան, որի երկու ելանյութերից մեկը ջուրն է։
Օքսիդների ֆիզիկական հատկություններ
Սովորական պայմաններում հիմնային և երկդիմի օքսիդները, որպես կանոն, պինդ նյութեր են, տարբեր գույների ` սպիտակ, սև, մուգ դարչնագուն, մուգ կանաչ և այլն։Հիմնային օքսիդները լավ են լուծվում ջրում կամ այլ կերպ ասած փոխազդում ջրի հետ ու առաջացնում ալկալի։Երկդիմի օքսիդները ջրում գործնակաանում անլուծելի են կամ ջրի հետ չեն փոխազդում։։ Թթվային օքսիդները սովորական պայմաններում կարող են լինել և՛ պինդ վիճակում, և՛ հեղոուկ վիճակում։դրանք կարող են լինել անգույն կամ ամենատարբեր գույներով ։ Անտարբեր օքսիդները ջրում նույնպես գործնականորեն անլուծելի գազեր են
Комментариев нет:
Отправить комментарий