Քիմիական ռեակցիաները բազմաթիվ են ու բազմաբնույթ: Մի շարք ընդհանուր հատկությունների համաձայն, քիմիական ռեակցիաները հնարավոր է դասակարգել, որը բավական դյուրացնում է նրանց ուսումնասիրությունը:
Ըստ սկզբնանյութերի և վերջանյութերի թվի ու բաղադրության՝ ռեակցիաները լինում են.
- միացման
- քայքայման
- տեղակալման
- փոխանակման
Միացման քիմիական ռեակցիայի ժամանակ երկու կամ ավելի նյութերից ստացվում է մեկ բարդ նյութ:
Օրինակ, երկու բարդ նյութերի՝ կալցիումի օքսիդի և ջրի փոխազդեցությունից ստացվում է մեկ ավելի բարդ նյութ՝ կալցիումի հիդրօքսիդ:
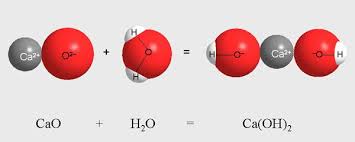

Կալցիումի օքսիդի և ջրի միացման ռեակցիան
Երկու պարզ նյութերի՝ ալյումինի և յոդի փոխազդեցությունից առաջանում է մեկ բարդ նյութ՝ ալյումինի յոդիդ:




Ալյումինի և յոդի միացման ռեակցիան
Քայքայման ռեակցիայի ժամանակ մեկ բարդ նյութի քայքայումից ստացվում են երկու կամ ավելի նյութեր:
Ստացվող նյութերը կարող են լինել և՛բարդ, և՛ պարզ:
Օրինակ, մեկ բարդ նյութից՝ պղնձի (II) հիդրոքսիդի քայքայումից առաջանում են երկու բարդ նյութ՝ պղնձի (II) օքսիդ և ջուր:


Պղնձի (II) հիդրոքսիդի քայքայումը
Մեկ բարդ նյութի՝ ջրի քայքայումից առաջանում են երկու պարզ նյութ՝ջրածին և թթվածին:

Ջրի քայքայումը
Տեղակալման է պարզ և բարդ նյութերի միջև ընթացող այն քիմիական ռեակցիան, որի ժամանակ պարզ նյութը կազմող ատոմները տեղակալում են բարդ նյութի բաղադրությունում առկա տարրերից որևէ մեկի ատոմները:
Օրինակ, պարզ նյութ՝ ցինկի և բարդ նյութ աղաթթվի փոխազդեցությունից առաջանում են նոր պարզ նյութ՝ ջրածին և բարդ նյութ՝ ցինկի քլորիդ:

Ցինկի և աղաթթվի փոխազդեցությունը.
Քիմիական կապը, որն առաջանում է երկու ատոմի միջև ընդհանրացված էլեկտրոնային զույգի միջոցով կոչվում է կովալենտային:
Օրինակ
Ջրածնի ատոմները միանում են մեկ ընդհանուր էլեկտրոնային զույգով՝ ըստ հետևյալ ուրվագրի՝
Նոր առաջացած էլեկտրոնային զույգը, որն անվանվում է նաև ընդհանրացված, միաժամանակ և հավասարաչափ պատկանում է ջրածնի երկու ատոմին: Ընդհանուր էլեկտրոնային զույգը ձգվում է ջրածնի երկու ատոմների դրական լիցքավորված միջուկների կողմից, «ցեմենտում» դրանք՝ ապահովելով մոլեկուլի կայունությունը:
Իոնային կապ
Քիմիական կապի առաջացման հիմնական շարժիչ ուժն ատոմի՝
Քննարկենք, թե ինչպես կարող է քիմիական կապ առաջանալ էլեկտրաբացասականությամբ միմյանցից կտրուկ տարբերվող ատոմների միջև, օրինակ` նատրիումի (Na) և ֆտորի(F):
Նատրիումի ատոմն իր արտաքին շերտի մեկ էլեկտրոնը տրամադրում է ֆտորի ատոմին և փոխարկվում է ութ էլեկտրոն պարունակող, կայուն, դրական լիցքավորված մասնիկի, այսինքն` ստացվում է նեոն
Ֆտորի ատոմն արտաքին էլեկտրոնային շերտում յոթ էլեկտրոն ունի, և կայուն վիճակի համար ֆտորի ատոմին ընդամենը մեկ էլեկտրոն է պակասում, ուստիև ավարտուն արտաքին էներգիական մակարդակ ստանալու համար շատ ավելի հեշտ է այդ ատոմին մեկ էլեկտրոն միացնել: Այդ մեկ էլեկտրոնը նատրիումի ատոմից վերցնելիս ֆտորի ատոմը փոխարկվում է 8 էլեկտրոն պարունակող, կայուն արտաքին շերտով, բացասական լիցքավորված մասնիկի այսինքն, ստացվում է նեոն (Ne) իներտ գազի էլեկտրոնային կառուցվածք.
Դրական (Na+) և բացասական F− մասնիկների միջև էլեկտրաստատիկական ձգողության ուժեր են ծագում, և որպես արդյունք՝ առաջանում է նատրիումի ֆտորիդ նյութը:
Комментариев нет:
Отправить комментарий